Onderzoek naar het ontstaan van cardiomyopathie
Vorig jaar startte Hartedroom samen met de Hartstichting twee grote onderzoeksprojecten. Een daarvan wordt gecoördineerd vanuit Groningen en kijkt naar het ontstaan van cardiomyopathie; meer specifiek de rol van zgn chaperone eiwitten in gedilateerde cardiomyopathie.
Hartspierziekten, waaronder gedilateerde cardiomyopathie (DCM), zijn een van de meest voorkomende oorzaken van hartfalen bij kinderen. 20 tot 30% procent van de DCM patiënten heeft een erfelijke vorm van DCM. Bij deze patiënten zorgt een fout in het DNA, een mutatie, ervoor dat er een veranderd (gemuteerd) eiwit
wordt aangemaakt. Eiwitten zijn belangrijke onderdelen van het menselijk lichaam en vervullen vele verschillende functies, waaronder het samentrekken van de hartspier. Veel van de mutaties die DCM veroorzaken betreffen zogenaamde contractiele eiwitten, die ervoor zorgen dat de hartcellen kunnen samentrekken. Deze mutaties leiden vaak tot zwakke contractiele eiwitten die bij het samentrekken sneller dan normaal kapot gaan.
De mutaties waar wij binnen dit project naar kijken betreffen mutaties in een andere groep eiwitten, die ervoor moeten zorgen dat “versleten” contractiele eiwitten worden opgeruimd om zo weer nieuwe contractiele bundels te kunnen opbouwen. Deze eiwitten, genaamd HSPB5, HSPB7 en Bag3, behoren tot een groep van eiwitten die we “chaperones” noemen. Net zoals een chaperone vroeger een persoon moest begeleidden zodat alles netjes verliep, begeleiden deze eiwitten andere eiwitten om er voor te zorgen dat cellen hun functie goed kunnen uitoefenen. We denken dat de mutaties in deze chaperone eiwitten deze “zorgfunctie” ten behoeven van het goed kunnen samentrekken van de hartspiercellen hebben verloren. Het doel van ons project is om precies uit te zoeken of dit zo is. Naast dat we daarmee meer te weten komen over hoe de mutaties in deze chaperone eiwitten leiden tot DCM, hopen we ook inzicht te krijgen in manieren om deze zorgfunctie te herstellen. Bijvoorbeeld door activatie andere chaperones te stimuleren: daar zijn er namelijk wel meer dan 100 verschillende vormen van in cellen. Wellicht kan verbetering van deze verzorgingsfuncties ook van nut zijn bij de andere DCM veroorzakende mutaties in contractiele eiwitten die veel sneller versleten raken en dus sneller vervangen moeten worden.
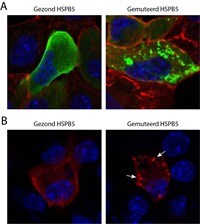
We zijn begonnen met het kijken naar het eiwit HSPB5, waarin verschillende mutaties allemaal leiden tot DCM bij kinderen (of soms volwassenen). Om deze mutaties en de effecten hiervan op hartspiercellen te bestuderen, maken we gebruik van een hartspiercellijn. Deze cellijn bezit alle eiwitten die nodig zijn voor het samentrekken van de cel. Onze eerste resultaten wijzen er op dat door deze HSPB5 mutanten de hartspiercellen inderdaad niet goed meer kunnen samentrekken. Om vervolgens een oorzaak hiervoor te vinden, gebruiken we biochemische en microscopische technieken. Gezond HSPB5 is mooi verspreid aanwezig in cellen (Figuur 1A, links). Echter, gemuteerde HSPB5 eiwitten zijn vaak niet mooi verspreid, maar lijken eiwitklontjes te vormen (zie figuur 1A, rechts).
Als we vervolgens bestuderen wat er met contractiele eiwitten gebeurd, zoals bijvoorbeeld een eiwit genaamd TroponineT dat heel belangrijk is voor het samentrekken van de hartspier cellen, zien we dat dit met gezond HSPB5 mooi in een bundel rond de cel ligt, terwijl TropinineT in aanwezigheid van het mutante HSPB5 ook klontjes vormt in sommige cellen (figuur 1B, rechts). Dit ondersteunt dus onze gedachte dat door het mutante HSPB5 de onderhoudsfunctie van TroponineT, en wellicht andere contractiele eiwitten verloren gaat, waardoor de hartspiercel niet goed meer kan samentrekken. We zijn nu met diverse andere technieken bezig om deze hypothese verder te toetsen en om te bepalen wat de onderhoudsfunctie van HSPB5 precies is (bijvoorbeeld proteasomen, de cellulaire “papierversnipperaar" van eiwitten).
Naast HSPB5 kijken we ook naar mutaties in het BAG3 eiwit die ook leiden tot DCM. We onderzoeken voornamelijk 1 specifieke mutatie die leidt tot DCM en spierafbraak in hele jonge kinderen, de zogenaamde BAG3-P209L mutatie. BAG3-P209L mutatie vormt net zoals de HSPB5 mutanten klontjes in de cellen. De BAG3-klontjes lijken zich echter wel te onderscheiden van de HSPB5 klontjes. Recentelijk hebben we namelijk gevonden dat gezond BAG3 betrokken is bij een proces dat we “autofagie” noemen. Autofagie is een soort cellulaire verbrandingsoven voor afval van kapotte eiwitten, waarbij BAG3 als een soort bestuurder van de afvalophaalwagen kan worden gezien. Dit proces van afvalophalen lijkt te zijn verstoord in cellen met het mutante BAG3-P209L, waardoor het afval ophoopt en samenklontert, als gevolg waarvan het functioneren van hartspiercellen lijkt te worden verstoord.
Het onderzoek naar HSPB5 en BAG3 duidt er dus beide op dat hun ondersteuning en zorgfunctie inderdaad van groot belang is voor het functioneren van de hartspiercellen. De precieze manier waarop dit echter misgaat moet nog verder worden onderzocht om vervolgens gerichter te kunnen proberen om uit te zoeken of het verlies van deze functie bij de mutante HSPB5 of BAG3 ook hersteld kan worden met behulp van stimuleren van andere chaperones. Dit is waarop onze vervolgstudies zich nu richten.
Jan J. Vonk, postdoctoraal medewerker aangesteld op het Hartedroom project
. dr. Bianca .J.M.M. Brundel en Prof. dr. Harm H. Kampinga, project leiders
Figuur 1.
A) Een cel met, in groen, HSPB5 (links) of gemuteerd HSPB5 (rechts). Gemuteerd HSPB5 vormt klontjes. Het actine cytoskelet is hier in rood en de kern van de cel in blauw.
B) Een cel met HSPB5 (links) of met gemuteerd HSPB5 (rechts). TroponineT is in rood en vormt in de cel rechts kleine klontjes (zie de pijltjes). De kern van de cel is in blauw.
Nieuws
Verband vet rondom het hart en hartspierziekte
Patiënten met de erfelijke hartspierziekte PLN krijgen sneller levensgevaarlijke hartritmestoornissen als zij meer vet rondom hun hart hebben. Veel vet lijkt de kans op deze hartritmestoornissen, die een hartstilstand kunnen veroorzaken, zelfs te verdubbelen.



